제제균일성시험법
Uniformity of Dosage Units
제제균일성시험법은 개개 제제 간의 주성분 함량의 균일한 정도를 나타내기 위한 시험법으로 따로 규정이 없는 한 단일제 또는 복합제에 함유된 개개의 주성분에 대하여 적용한다. 다만 현탁제, 유제 또는 겔제로 된 외용의 피부적용제제에서는 이 시험을 적용하지 않는다.
제제균일성은 표 1 에 따라 함량균일성시험 또는 질량편차시험 중 어느 한 방법으로 시험한다. 함량균일성시험은 제제 개개의 주성분의 함량을 측정하여 각각의 성분의 함량이 허용범위 내에 있는지를 확인하는 시험이며, 질량편차시험법은 제제 질량의 편차를 함량의 편차로 보고 개개 제제의 질량을 측정하여 제제 중 주성분 함량의 균일성을 추정하는 시험방법이다.

The term "Uniformity of dosage unit" is defined as the degree of uniformity in the amount of the drug substance among dosage units. Therefore, the requirements of this chapter apply to each drug substance being comprised in dosage units containing one or more drug substances, Unless otherwise specified elsewhere in this Pharmacopoeia.
To ensure the consistency of dosage units, each unit in a batch should have a drug substance content within a narrow range around the label claim. Dosage units are defined as dosage forms containing a single dose or a part of a dose of a drug substance in each dosage unit.
Unless otherwise specified, Uniformity of Dosage Units Test is test method to expressed uniformity of contents of principal constituent in the preparations.
The Uniformity of Dosage Units specification is not intended to apply to suspension, emulsions, or gels in unit-dose containers intended for external, cutaneous administration.
The Uniformity of Dosage Units can be demonstraited by either of two methods, Content uniformity or Mass variation (see Table 1).
The test for Content Uniformity of preparations presented in dosage units is based on the assay of the individual contents of drug substance of a number of dosage units to determine whether the individual contents are within the limits set. The Content Uniformity method may be applied in all cases.

질량편차시험은 다음의 경우에 적용한다.
(1) 모든 성분이 완전하게 녹아 균질하게 된 액을 개별 용기에 넣은 제제 (연질캡슐을 포함한다).
(2) 다른 주성분 및 첨가제를 함유하지 않고 한 성분으로만 된 제제 중 산제, 과립제 및 쓸 때 녹여 쓰는 주사제 등의 고형제제를 개별 용기에 넣은 제제
(3) 모든 성분이 완전하게 녹은 액을 최종용기 내에서 동결건조하여 만든, 쓸 때 녹여 쓰는 주사제 등의 고형제제로 제법이 라벨 또는 첨부문서에 기재되어 있는 제제
(4) 경질캡슐제, 나정 또는 필름코팅정으로 주성분 함량이 25 mg 이상이고 동시에 제제 중 주성분의 비율이 질량비로서 25 % 이상인 경우 해당 성분. 다만 주성분을 함유하지 않는 코팅층, 공캡슐 등을 제외하고 계산하며 주성분이 2개 이상일 때는 각각의 성분에 대하여 계산한다.
(5) 주성분의 함량기준이 표시량에 대한 허용편차 10 %를 벗어나는 제제 중 해당 성분
(6) 의약품 각조에 질량편차시험법을 적용하는 제제
위의 조건을 만족하지 않는 제제는 함량균일성시험을 한다. 다만 (4)에 명시된 제제에서 25 mg과 25 %의 역치에 달하지 않을 때도 제조공정의 밸리데이션 및 제제개발 자료에서 최종제제의 주성분 농도의 상대표준편차 (RSD)가 2 % 이하이며 질량편차시험으로의 시험법의 변경이 인정된 때는 질량편차시험을 적용한다. 주성분농도의 상대표준편차 (RSD)는 개개 제제에 대한 주성분농도 (w/w, w/v) 의 상대표준편차이며, 주성분농도는 개개 제제 중의 주성분함량을 제제 질량으로 나누어 구한다. 상대표준편차 (RSD)의 일반식은 표 2를 참조한다.
The test for Mass Variation is applicable for the following dosage forms:
(1) solutions enclosed in unit-dose containers and into soft capsules in which all components are perfectly dissolved;
(2) solids (including powders, granules and sterile solids) that are packaged in single-unit containers and contain no active or inactive added substances;
(3) solids (including sterile solids) that are packaged in singer-unit containers, with or without active or inactive added substances, that have been prepared from true solutions and freeze-dried in the final containers and are labeled to indicate this method of preparation; and
(4) hard capsules, uncoated tablets, or film-coated tablets, containing 25 mg or more of a drug substance comprising 25 % or more, by weight, of the dosage unit or, in the case of hard capsules, the capsule contents, or in the case of film-coated tablets, the precoated tablets, except that uniformity of other drug substances present in lesser proportions is demonstrated by meeting Content Uniformity requirements.
(5) Corresponding constituent of preparation that the content uniformity of major constituent is more than 10 % allowance variation to the expressed volume.
(6) Mass Variation Test is applied to the monograph.
The test for Content Uniformity is required for all dosage forms not meeting the above conditions for the Mass Variation test. Alternatively, products listed in item (4) above that do not meet the 25mg/25 % threshold limit may be tested for uniformity of dosage units by Mass Variation instead of the Content Uniformity test if the concentration relative standard deviation (RSD) of the drug substance in the final dosage units is not more than 2 %, based on process validation data and development data, and if there has been regulatory approval of such a change.
The concentration RSD is the RSD of the concentration per dosage unit (w/w or w/v), where concentration per dosage unit equals the assay result per dosage unit divided by the individual dosage unit weight. See the RSD formula in Table 2.



질량편차시험
이 시험은 주성분농도(주성분 질량을 제제 질량으로 나눈 것)가 균일하다고 가정하고 행하는 시험이다.
적당한 방법으로 로트를 대표하는 검체에 대하여 측정하여 주성분의 평균함량을 구한다. 이 값을 A로 하여 판정값의 계산항에 명시된 대로 표시량에 대한 %로 나타낸다. 검체 30 개 이상을 취하여 아래의 방법에 따라 시험한다.
나정 또는 필름코팅정 검체 10 개를 가지고 개개의 질량을 정밀하게 달아 정량법에 따라 구한 평균함량으로부터 계산으로 개개 검체의 함량추정값을 구하여 표시량에 대한 %로 나타내고 판정값을 계산한다.
경질캡슐제 검체 10 개를 가지고 검체와 질량의 대응성에 유의하면서 개개의 질량을 캡슐을 포함하여 정밀하게 단다. 캡슐에서 내용물을 적절한 방법으로 제거하고 개개의 빈 캡슐의 질량을 정밀하게 단다. 개개의 검체의 질량에서 대응하는 빈 캡슐의 질량을 빼서 개개의 내용물의 질량을 구한다. 내용물의 질량과 정량법에 따라 구한 평균함량을 가지고 개개 검체의 평균함량을 계산하여 표시량에 대한 %로 표시하고 판정값을 계산한다.
연질캡슐제 검체 10 개를 가지고 검체와 질량의 대응성에 유의하면서 개개의 질량을 캡슐을 포함하여 정밀하게 단다. 캡슐을 잘라 열고 내용물을 적당한 용매로 씻어 낸다. 실온에서 약 30 분간 방치하여 잔존하고 있는 용매를 증발시켜 제거한다. 이 때 캡슐이 흡습 또는 건조하는 것을 막아야 한다. 개개의 빈 캡슐의 질량을 정밀하게 달아 개개의 검체의 질량에서 대응하는 빈 캡슐의 질량을 빼서 내용물의 질량을 구한다. 내용물의 질량과 정량법에 따라 구한 평균함량을 가지고 개개 검체의 평균함량을 계산하여 표시량에 대한 %로 표시하고 판정값을 계산한다.
정제와 캡슐제 이외의 고형제제 ‘경질캡슐’의 항에 기재한 방법과 같이 개개의 제제를 처리하여 판정값을 계산한다.
액상제제 검체 10 개를 가지고 내용물의 질량 또는 용량과 정량법에 따라 구한 평균함량을 가지고 개개 검체의 평균함량을 계산하여 표시량에 대한 %로 표시하고 판정값을 계산한다.
판정값의 계산 ‘함량균일성시험’의 항에 따라 판정값을 계산한다. 다만

는 A 로, 개개 검체의 주성분함량은 아래에 표시된 주성분함량 추정치로 치환한다.

Mass variation
Mass Variation is carried out based on the assumption that the concentration (mass of drug substance per mass of dosage unit) is uniform in a lot. Carry out an assay for the drug substances on a representative sample of the batch using an appropriate analytical method. This value is result A, expressed as % of label claim (see Calculation of the Acceptance Value). Select not less than 30 dosage units, and proceed as follows for the dosage form designated.
Uncoated or film-coated Tablets. Accurately weigh 10 tablets individually. Calculate the content, expressed as % of label claim, of each tablet from the mass of the individual tablets and the result of the assay. Calculate the acceptance value.
Hard Capsules. Accurately weigh 10 capsules individually, taking care to preserve the identity of each capsule. Remove the contents of each capsule by suitable means. Accurately weigh the emptied shells individually, and calculate for each capsule the net mass of its contents by subtracting the mass of the shell from the respective gross mass. Calculate the drug substance content of each capsule from the mass of the individual capsules and the result of the assay. Calculate the acceptance value.
Soft Capsules. Accurately weigh the 10 intact capsules individually to obtain their gross masses, taking care to preserve the identity of each capsule. Then cut open the capsules by means of a suitable clean, dry cutting instrument such as scissors or a sharp open blade, and remove the contents by washing with a suitable solvent. Allow the occluded solvent to evaporate from the shells at room temperature over a period of about 30 min, taking precautions to avoid uptake or loss of moisture. Weigh the individual shells, and calculate the net contents. Calculate the drug substance content in each capsule from the mass of product removed from the individual capsules and the result of the assay. Calculate the acceptance value.
Solid dosage forms other than tablets and capsules
Proceed as directed for Hard Capsules, treating each dosage unit as described therein. Calculate the acceptance value.
Liquid dosage forms Accurately weigh the amount of liquid that is removed from each of 10 individual containers in conditions of normal use. Calculate the drug substance content in each container from the mass of roduct removed from the individual containers and the result of the assay. Calculate the acceptance value.
Calculation of Acceptance Value
Calculate the acceptance value as shown in Content Uniformity, except that the value of X is replaced with A, and that the individual contents of the dosage units are replaced with the individual estimated contents defined below.
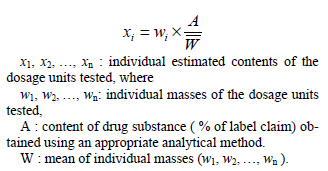
판정기준
따로 규정이 없는 한 다음의 판정기준을 적용한다.
고형제제 및 액상제제 처음의 검체 10 개를 가지고 판정값을 계산하여 그 값이 L1 %를 넘지 않을 때 적합하다.
만약 판정값이 L1 %를 넘을 때는 다시 남아있는 검체 20 개를 가지고 같은 방법으로 시험하여 판정값을 계산한다. 2 회의 시험을 합한 30 개의 검체의 판정값이 L1 %를 넘지 않고 동시에 개개 제제의 함량이 함량균일성시험 또는 질량편차시험의 ‘판정값의 계산’의 항에 표시된 (1- L2 × 0.01 ) M 이상이며 또한 (1 + L2 × 0.01 ) M 을 초과하는 것이 없을 때 적합하다. 따로 규정이 없는한 L1은 15.0, L2는 25.0 이다.
질량편차 적용 제제의 (5)에 해당하는 경우
1) 과립제·산제·시럽제·액상제제 (분포) 제제 20 개 를 가지고 그 질량을 정밀하게 달아 평균질량을 계산할때 그 값과 개개 질량의 편차가 10 % 이하일 때 적합하다. 편차가 10 %를 넘는 것이 있을 때에는 내용물을 가지고 다음 시험을 한다. 제제 20 개를 취하여 개개의 질량을 정밀하게 단다. 이때 개개의 번호를 기록하는 등으로 식별하며 각 제제와 그 질량이 대응하도록 조심한다. 포장을 열고 내용물을 작은 붓 등으로 제거하고 개개의 빈 포장의 질량을 정밀하게 단다. 개개의 질량에서 대응하는 빈 포장의 질량을 빼어 제제 내용물의 양으로 한다. 20 개의 내용물 질량을 구하여 평균질량을 계산할 때 그 값과 개개 질량과의 편차가 10 %를 넘는 것이 2 개 이하 이고 25 %를 넘는 것이 없을 때 적합하다.
2) 정제 제제 20 개를 가지고 그 질량을 정밀하게 달아 평균 질량을 계산할 때 그 값과 개개 질량과의 편차는 다음 값을 넘는 것이 있어도 2 개 이하이고 2 배를 넘는 것이 없을 때 적합하다.

3) 좌제 제제 20 개를 가지고 질량을 정밀하게 달아 평균 질량을 계산할 때 그 값과 개개의 질량과의 편차는 5 % 이하이고 5 %를 넘고 7.5 % 이하인 것이 2 개 이하일 때 적합하다.
4) 주사제 (쓸 때 녹이거나 현탁하는 주사제) 제제 10 개를 가지고 표시서를 떼고 바깥을 물로 씻어 충분히 건조한 다음 데시케이터에서 항량이 될 때까지 방치하여 질량을 정밀하게 단다. 조심하여 개봉하여 내용물을 버리고 용기의 각 부분을 물 및 에탄올로 잘 씻어 말리고 데시케이터에서 항량이 될 때까지 건조한 다음 그 질량을 정밀하게 단다. 전후 질량의 차이를 내용물의 질량으로 한다. 10 개 내용물의 평균질량을 계산할 때 그 값과 개개 질량과의 편차는 다음 값을 넘는 것이 있어도 1 개 이하이고 2 배를 넘는 것이 없을 때 적합하다.

5) 캡슐제 가) 경질캡슐제 제제 20 개를 가지고 질량을 정밀하게 달아 평균질량을 계산할 때 그 값과 개개의 질량과의 편차가 10 % 이하일 때 적합하다. 다만 이 범위를 벗어날 때에는 제제 20 개를 가지고 개개 질량을 정밀하게 단다. 이 때 개개 캡슐에 번호를 기록하는 등으로 식별하여 각 캡슐과 질량이 대응하도록 조심한다. 캡슐을 열어 내용물을 작은 붓 등으로 제거하고 개개의 빈 캡슐의 질량을 정밀하게 단다. 개개의 캡슐 질량에서 대응하는 빈 캡슐의 질량을 빼어 캡슐 내용물의 질량으로 한다. 20 개 개개 내용물의 질량을 구하여 평균질량을 계산할 때 그 값과 개개 질량과의 편차가 평균질량의 10 %를 넘는 것이 2 개 이하이고 25 %를 넘는 것이 없을 때 적합하다.
나) 연질캡슐제 제제 20 개를 가지고 개개의 질량을 정밀하게 단다. 이 때 개개의 캡슐에 번호를 기록하는 등으로 식별하여 각 캡슐과 그 질량이 대응하도록 조심한다. 캡슐을 열고 그 내용물을 에테르 등의 휘발성 용매로 씻어 낸 다음 여과지 등으로 빈 캡슐에서 용매를 가볍게 제거하고 실온에서 방치하여 캡슐에 묻어 있는 용매를 제거 한다. 이 때 캡슐이 흡습 또는 건조되는 것을 피한다. 개개 빈 캡슐의 질량을 정밀하게 달아 개개의 캡슐 질량에서 대응하는 빈 캡슐의 질량을 빼어 그 캡슐 내용물의 질량으로 한다. 20 개의 평균질량을 계산할 때 그 값과 개개 질량과의 편차가 10 %를 넘는 것이 2 개 이하이고 25 %를 넘는 것이 없을 때 적합하다. 편차가 10 %를 넘고 25 % 이하인 것이 3 ~ 6 개일 때는 다시 40 개를 가지고 같은 방법으로 내용물의 질량을 달아 60 개에 대한 평균질량을 계산할 때 그 값과 개개 질량과의 편차가 10 %를 넘는 것이 6 개 이하이고 25 %를 넘는 것이 없을 때 적합하다.
6) 트로키제 제제 20 개를 가지고 질량을 정밀하게 달아 평균질량을 계산할 때 그 값과 개개 질량과의 편차가 10 % 이하이거나 10 %를 넘는 것이 있더라도 2 개 이하이고 20 %를 넘는 것이 없을 때 적합하다.
Criteria
Apply the following criteria, unless otherwise specified.
Solid and Liquid Dosage Forms The requirements for dosage uniformity are met if the acceptance value of the first 10 dosage units is less than or equal to L1 %.If the acceptance value is greater than L1 %, test the next 20 dosage units and calculate the acceptance value. The requirements are met if the final acceptance value of the 30 dosage unit is less than or equal to L1 % and no individual content of the dosage unit is less than(1- L2 × 0.01) M nor more than (1 + L2 × 0.01 )M is Calculation of Acceptance Value under Content Uniformity or under Mass Variation. Unless otherwise specified, L1 is 15.0 and L2 is 25.0.
In the case of equivalent to (5) of preparations by the application of mass variation.
1) Granules, powers, syrups and liquid preparations in single-unit containers(divided) Take 20 containers, weigh accurately mass of each container, calculate the mean mass and variation between the mean value and the mass of each container is not more than 10 % to meet the requirements. When the difference is more than 10 % in any of them, proceed to the following test with the content. Take 20 containers and weigh accurately mass of each container. In doing this, pay attention to relate the measured mass with each container by identifying each container with numbers or any other marks. Open the container, remove the content with a small brush or any suitable tool and weigh the mass of the empty container. Calculate the mass of the content by subtracting the mass of the empty container from the mass of each of the corresponding container. Calculate the mass of the content of each of 20 containers and the mean mass. In not more than 2 containers, variation between the mean value and mass of content of each container is more than 10 % and variation of more than 25 % is not observed, to meet the requirements.
2) Tablets Take 20 tablets, weigh accurately mass of each tablet, calculate the mean mass and variation between this mean value and the mass of each tablet is not more than the following values, the number of outliers is not more than 2 and the variation of more than 2 times of the following values is not observed, to meet the requirements.

3) Suppositories Take 20 suppositories, weigh accurately mass of each suppository, calculate the mean mass and variation between this mean value and the mass of each suppository is not more than 5 % and the number of suppositories of which variations are more than 5 % and not more than 7.5 % is not more than 2, to meet the requirements.
4) Injections(to be reconstituted or suspended before use) Take 10 injections, wash the exterior of the container of each injection after removal of paper label, if any, dry it completely in a desiccator to get a constant mass and weigh accurately the mass. Open carefully the containers, remove the contents, wash all parts of each container with water and ethanol, air dry, dry in a desiccator to get a constant mass and weigh accurately all parts of each of the opened containers. Calculate the net mass of the content as a difference of masses before and after removal of the contents. Calculate the mean mass of the contents of 10 injections and the variation between the mean value and each mass. The number of outliers by the following values is not more than 1 and the variation of more than 2 times of the following values is not observed, to meet the requirements.

5) Capsules i) Hard Capsules Take 10 capsules and weigh accurately mass of each capsule, calculate the mean mass and variation between the mean value and the mass of each capsule is not more than 10 % to meet the requirements. When the difference is more than 10 % in any of them, take 20 capsules and weigh accurately mass of each capsule. In doing this, pay attention to relate the measured mass with each capsule by identifying each capsule with numbers or any other marks. Open the capsule, remove the content with a small brush or any suitable tool and weigh the mass of the empty capsule. Calculate the mass of the content by subtracting the mass of the empty capsule from the mass of each of the corresponding capsule. Calculate the mass of the content of each of 20 capsules and the mean mass. In not more than 2 capsules, variation between the mean value and mass of content of each capsule is more than 10 % and variation of more than 25 % is not observed, to meet the requirements.
ii) Soft Capsule Take 20 capsules and weigh accurately mass of each capsule. In doing this, pay attention to relate the measured mass with each capsule by identifying each capsule with numbers or any other marks. Open the capsule, remove the content by washing with volatile solvent such as ether, remove the remaining solvent of the empty capsule by touching with a filter paper or any other suitable materials, leave the capsules in a room temperature to remove the remaining solvent. In doing this, prevent capsules from moisture absorption or drying. Weigh the mass of the empty capsule. Calculate the mass of the content by subtracting the mass of the empty capsule from the mass of each of the corresponding capsule. Calculate the mean mass of the contents of 20 capsules. In not more than 2 capsules, variation between the mean value and mass of content of each capsule is more than 10 % and variation of more than 25 % is not observed, to meet the requirements.
When the number of capsules of which variations are more than 10 % and not more than 25 % is 3 to 6, repeat the test with additional 40 capsules and calculate the mean value of the contents of total 60 capsules. In not more than 6 capsules, variation between the mean value and mass of content of each capsule is more than 10 % and variation of more than 25 % is not observed, to meet the requirements.
6) Troches Take 20 troches, weigh accurately masses and calculate the mean mass. The variation between the mean value and the mass of each troche is not more than 10 %, the number of outliers by 10 % is not more than 2 and variation of more than 20 % is not observed, to meet the requirements.
'의약품 품질관리(QC)' 카테고리의 다른 글
| [대한약전/KP] 불용성이물시험법 Foreign Insoluble Matter Test (0) | 2022.02.28 |
|---|---|
| [대한약전/KP] 제제균일성시험법 (함량균일성시험) Uniformity of Dosage Units (Content uniformity) (0) | 2022.02.24 |
| [대한약전/KP] 잔류용매시험법 (0) | 2022.02.21 |
| [대한약전/KP] 기체크로마토그래프법 Gas Chromatography (0) | 2022.02.19 |
| [대한약전/KP] 액체크로마토그래프법 Liquid Chromatography (0) | 2022.02.18 |




댓글